1.119.492
kiadvánnyal nyújtjuk Magyarország legnagyobb antikvár könyv-kínálatát
Elméleti fizikai kémia II.
Egyetemi tankönyv
| Kiadó: | Tankönyvkiadó |
|---|---|
| Kiadás helye: | Budapest |
| Kiadás éve: | |
| Kötés típusa: | Félvászon |
| Oldalszám: | 864 oldal |
| Sorozatcím: | |
| Kötetszám: | |
| Nyelv: | Magyar |
| Méret: | 25 cm x 17 cm |
| ISBN: | |
| Megjegyzés: | Fekete-fehér ábrákkal. |
naponta értesítjük a beérkező friss
kiadványokról
naponta értesítjük a beérkező friss
kiadványokról
Tartalom
| TÖBBKOMPONENSŰ RENDSZEREK. ELEGYFÁZISOK FIZIKAI EGYENSÚLYAI | |
| Homogén elegyfázisok termodinamikai sajátságai | |
| Elegyek, oldatok és keverékek | 1 |
| Elegyek összetételének (koncentrációjának) különböző kifejezései | 3 |
| Tökéletes gázelegyek | 7 |
| Reális gázelegyek | 11 |
| Parciális moláris mennyiségek | 15 |
| Elegyképződés hőeffektusai: oldáshők | 21 |
| Q-x- és H-x-diagrammok | 26 |
| A komponensek kémiai potenciálja és fugacitása | 30 |
| Aktivitások és aktivitási koefficiensek | 34 |
| Híg oldatok és ideális elegyek törvényei | |
| Raoult és Henry törvényei | 40 |
| Az oldószerrel elegykristályt nem képező anyagok híg oldatainak fagyáspontcsökkenése; mólsúly meghatározása; anyagok tisztaságának megállapítása fagyáspontmérésekkel | 46 |
| Nem illó anyagok híg oldatainak forráspontemelkedése | 50 |
| Híg oldatok ozmózisnyomása | 52 |
| A híg oldatok törvényeinek statisztikus értelmezése és érvényességüknek ebből megállapítható korlátai | 56 |
| Kevéssé oldódó anyagok oldhatósága folyadékokban | 60 |
| Szilárd testek ideális oldhatósága: ideális eutektikumok | 62 |
| Nagy molekulájú anyagok oldatai | 67 |
| Kis mértékben vagy ideálisan oldódó gázok oldhatósága folyadékokban | 73 |
| Ideális folyadékelegyek tenziója, ha mindkét komponens illó | 76 |
| Gőztartalmú gázok; folyadékok tenziója nem oldódó idegen gáz jelenlétében; levegőnedvesség | 78 |
| Kétkomponensű nem-ideális elegyek fázisegyensúlyai | |
| A Gibbs-féle fázisszabály | 82 |
| Nem-ideális helyettesítéses elegyek viselkedésének statisztikus értelmezése | 86 |
| Korlátlanul elegyedő folyadékok tenziója | 94 |
| Korlátlanul elegyedő folyadékok forráspont- és egyensúlyi görbéi | 106 |
| Korlátoltan elegyedő folyadékok | 114 |
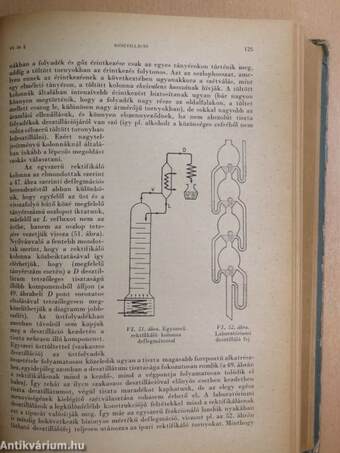
| Desztilláció | 119 |
| Oldhatóság és aktivitás folyadékokban | 127 |
| Oldott anyag megoszlása két oldószer között | 132 |
| Megoszláson alapuló szétválasztási eljárások (abszorpció és extrakció) | 135 |
| Nem-ideális eutektikumok | 141 |
| Szilárd oldatok I: helyettesítéses elegyek | 150 |
| Termikus analízis (fizikai-kémiai fázisanalízis) | 155 |
| Szilárd oldatok II: beékelődéses elegyek | 157 |
| Többkomponensű elgyek fázisegyensúlyai | |
| Egynél több oldott komponens híg oldatai | 166 |
| Háromkomponensű (terner) rendszerek egyensúlyi viszonyainak ábrázolása | 170 |
| Három korlátlanul elegyedő folyadék és gőzének egyensúlya | 172 |
| Korlátolt elegyedés három folyadék esetén | 176 |
| Kristályosodási viszonyok terner rendszerekben | 181 |
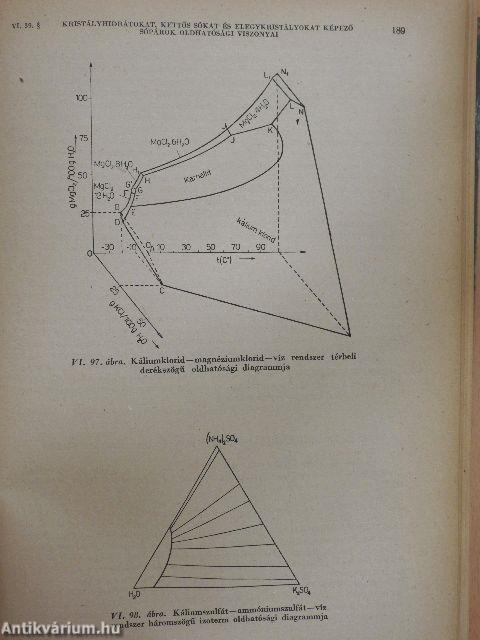
| Kristályhidrátokat, kettős sókat és elegykristályokat képező sópárok oldhatósági viszonyai | 185 |
| Transzportjelenségek folyékony oldatokban | |
| Folyadékelegyek viszkozitása | 190 |
| Híg oldatok viszkozitása | 193 |
| Kis molekulájú oldott anyagok diffúziója | 200 |
| Kolloid részecskék diffúziója | 205 |
| Ülepedési egyensúly és ülepedési sebesség | 208 |
| A KÉMIAI EGYENSÚLY | |
| Homogén egyensúlyok | |
| Egyensúly és reakciósebesség | 215 |
| Az egyensúlyi állandó | 217 |
| Egyensúlyi konverzió | 228 |
| Az egyensúly függése a hőmérséklettől | 233 |
| A Le Chatelier-Braun-féle elv | 237 |
| A reakcióizoterma pontos integrálása | 239 |
| Szimultán és részegyensúlyok | 243 |
| Standard és normál képződési szabad entalpiák | 251 |
| Heterogén egyensúlyok | |
| Heterogén reakciók affinitása és egyensúlyi állandója | 281 |
| Bomlási nyomások | 285 |
| Kristályhidrátok tenziója | 287 |
| A Nernst-féle hőtétel és a termodinamika harmadik főtétele | 289 |
| ADSZORPCIÓ | |
| Az adszorpció fajai és általános jelentősége | 295 |
| Adszorpció folyadékok szabad felületén | |
| Oldatok felületi feszültségének függése a koncentrációtól; Gibbs egyenlete | 297 |
| Kapilláraktív anyagok adszorpciós izotermái | 300 |
| Felszíni hártyák | 307 |
| Gázok és gőzök adszorpciója szilárd testek felületén | |
| Fizikai és kémiai adszorpció | 314 |
| Az adszorpciós egyensúly megfigyelése; mérési módszerek | 316 |
| Az adszorpció állapotegyenlete; tapasztalati tények | 321 |
| Langmuir izotermaegyenlete | 333 |
| Brunauer, Emmett és teller izotermaegyenlete (BET-egyenlet) | 343 |
| Termodinamikai potenciálelméletek | 348 |
| Adszorpciós hiszterézis: kapilláris kondenzálódás | 359 |
| Aktivált adszorpció | 364 |
| Adszropció elegyfázisokból és oldatokból | |
| Adszorpció gázelegyekből | 370 |
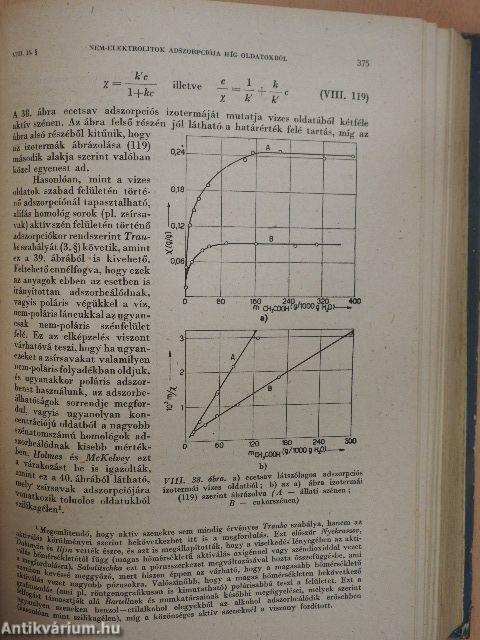
| Nem-elektrolitok adszorpciója híg oldatokból | 373 |
| Adszorpció teljes elegysorokból; negatív adszorpció | 378 |
| Adszorpció többkomponensű elegyekből; kromatográfia | 382 |
| Ionadszorpció erős elektrolitok oldataiból; ioncsere | 387 |
| KÉMIAI REAKCIÓK IDŐBELI LEFOLYÁSA ÉS MECHANIZMUSA (reakciókinetika) | |
| Általános alapelvek | |
| Reakciók osztályozása kinetikai szempontból | 396 |
| A reakciósebesség fogalma és mérése | 398 |
| A kinetikai tömeghatástörvény; reakciórend és sebességi állandó | 403 |
| Elsőrendű reakciók | 408 |
| Másod-, harmad- és törtrendű rakciók | 413 |
| A reakciórend és sebességi állandó megállapítása | 421 |
| Az egyszerű rendet zavaró hatások homogén fázisban | 423 |
| Reakciók áramló rendszerekben: térsebesség | 431 |
| A sebességi állandó változása a hőmérséklettel: Arrhenius egyenlete | 439 |
| Elemi reakciók átmeneti állapotának természete; egyeszerű és lépcsős reakciómechanizmusok | |
| Elemi reakciók molekularitása és rendje | 443 |
| Egyszerű bimolekulás reakciók sebességének elméletei | 446 |
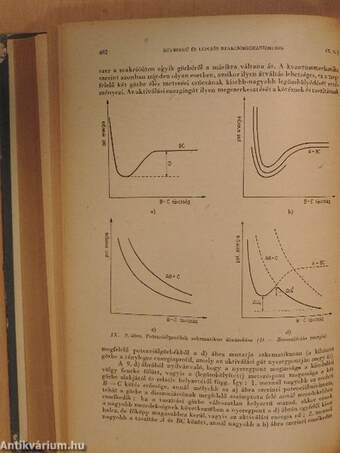
| Bimolekulás reakcióknak megfelelő potenciálfelületek | 457 |
| Egyesülési reakciók | 467 |
| Példák lépcsős atom-, gyök- és ionreakciókra | 471 |
| Unimolekulás reakciók | 482 |
| Trimolekulás reakciók | 489 |
| A közeg befolyása a reakciósebességre: oldószerhatás, primer sóhatás | 491 |
| Láncreakciók és katalízis | |
| Reakcióláncok és katalitikus mechanizmusok általános jelentősége | 495 |
| Szabad atomok és gyökök előállításának és kimutatásának módjai | 499 |
| Brómhidrogén és klórhidrogén keletkezése elemeikből | 502 |
| Szerves molekulák bomlásai homogén gázfázisban | 509 |
| Homogén gázkatalízis | 513 |
| Elágazó láncok; égési reakciók; robbanások | 517 |
| Oxidációs és katalitikus reakciók oldatokban | 528 |
| Soktagú polimerek képződése | 540 |
| Határfelületi reakciók | |
| Határfelületi reakciók típusai és ezek általános jellemvonásai | 552 |
| Heterogén reakciók, melyek sebességét a diffúzió szabja meg | 554 |
| Az adszorpció szerepe kontakt-katalízisekben | 555 |
| Homogén aktivitású felületen végbemenő reakciók sebességi egyenletei | 558 |
| Adszorbeált részecske és gázmolekula reakciója | 566 |
| Reakciógyorsítás és aktiválási hő | 570 |
| Változó aktivitású felületek | 574 |
| Ipari kontaktok előállítása, promotor- és hordozóhatás | 582 |
| ELEKTROKÉMIA | |
| Alapjelenségek | |
| Az áramvezetés módja, elektron- és ionvezetők | 587 |
| Faraday törvénye | 589 |
| Az oldott elektrolitok molekuláris állapota | 591 |
| Az elektrolitikus disszociáció létrejötte; az ionok hidratációja | 593 |
| Az oldószer hatása a disszociációra | 596 |
| Az elektromosság vezetése elektrolitokban | |
| Fajlagos, moláris és ekvivalens vezetőképesség | 597 |
| Az ionok vándorlási sebessége és mozgékonysága | 602 |
| Az átviteli szám | 604 |
| Hidratáció és komplexképződés hatása az átviteli számra | 608 |
| Az ekvivalens vezetőképesség kiszámítása az ionok mozgékonyságából | 610 |
| Az ionok relatív mozgékonyságának kiszámítása | 612 |
| A hidratáció hatása az ionmozgékonyságra | 615 |
| Elektrolitok diffúziója oldatban | 616 |
| Az ekvivalens vezetőképesség koncentrációtól való függésének okai | 619 |
| Gyenge elektrolitok vezetőképessége | 620 |
| Az erős elektrolitok vezetőképessége és molekuláris állapota | 622 |
| Az ionok közötti kölcsönhatás elmélete | 626 |
| Erős elektrolitoldatok vezetőképessége | 634 |
| Nagy térerősség (feszültségesés) és frekvencia hatása a vezetőképességre | 639 |
| A hőmérséklet hatása a vezetőképességre | 642 |
| A nyomás hatása a vezetőképességre | 645 |
| Az oldószer hatása a vezetőképességre (nem-vizes oldatok) | 646 |
| Olvadékok vezetőképessége | 648 |
| Szilárd vegyületek vezetőképessége | 648 |
| A vezetőképességmérés alkalmazásai | 651 |
| Galvánelemek és fázispotenciálok | |
| A galvánelemekről általában | 652 |
| Az e. m. e. és reakcióhő; az e. m. e. függése a hőmérséklettől | 655 |
| Az e. m. e. kiszámítása az egyensúlyi állandóból és függése a koncentrációtól | 659 |
| Az e. m. e. változása a nyomással | 664 |
| Az elektródpotenciálok | 665 |
| A standard potenciál | 669 |
| Gázelektródok | 675 |
| Keverékelektródok | 677 |
| Másodfajú elektródok | 680 |
| Koncentrációs elemek | 685 |
| Amalgámelektródok és -elemek | 692 |
| A potenciometrikus (eleketrometrikus) titrálás | 694 |
| Diffúziós potenciálok | 695 |
| Komplex ion- és szilárd sóképződés mint elektródfolyamat | 699 |
| Redoxi potenciálok | 701 |
| Változó vegyértékű fémek standard és redoxi standard potenciáljainak összefüggése | 708 |
| Az e. m. e. változása az oldószerrel | 710 |
| Folyadékhatár-potenciálok | 712 |
| Membránpotenciálok | 714 |
| Az üvegelektród | 717 |
| Galvánelemek és elektródpotenciálok sóolvadékokkal | 718 |
| Áramtermelésre gyakorlatilag használt galvánelemek | 719 |
| Az akkumulátorok | 724 |
| Egyensúlyok elektrolitoldatokban | |
| Elektrolitoldatok termodinamikai jellemzői | 727 |
| Az ozmotikus koefficiens | 730 |
| Az aktivitási koefficiens | 732 |
| Az ionerősség törvénye; az aktivitási koefficiens elmélete | 740 |
| Tömény oldatok aktivitási koefficiense | 746 |
| A gyenge elektrolitok disszociációs egyensúlya | 747 |
| Elektrolitok oldhatósága s annak változása idegen elektrolitok hatására | 751 |
| Nem-elektrolitok oldhatóságának változása elektrolitok hatására | 756 |
| A víz disszociációja | 757 |
| Savak és bázisok protolitikus elmélete | 762 |
| Savak és bázisok erőssége; protolitikus egyensúlyok | 767 |
| A szerkezet hatása savak illetve bázisok erősségére | 771 |
| A sók hidrolízise | 774 |
| A sav-bázis-indikátorok | 779 |
| A redoxi indikátorok | 785 |
| Kiegyenlítő (puffer-) oldatok | 788 |
| Amfoter elektrolitok | 791 |
| Az elektrolízis és polarizáció jelenségei | |
| Az elektrolízis feltételei; a bomlásfeszültség | 795 |
| A polarizáció és depolarizáció | 800 |
| A koncentrációs polarizáció és a diffúziós áram | 802 |
| A túlfeszültség | 804 |
| A passzivitás | 810 |
| A fémek korróziója és védelme | 813 |
| Olvadékok elektrolízise | 816 |
| Az elektrolízis legfontosabb gyakorlati alkalmazásai | 819 |
| Elektrokapilláris és elektrokinetikus jelenségek | |
| Az elektrokapillárgörbe | 827 |
| Az elektrokinetikus jelenségek, a kettősréteg szerkezete | 832 |
| Az elektroforézis | 835 |
| Az elektroozmózis | 837 |
| Áramlási potenciálok | 839 |
| Ülepedési potenciálok | 840 |
Témakörök
- Természettudomány > Kémia > Általános kémia > Általában
- Természettudomány > Kémia > Általános kémia > Halmazállapotok
- Természettudomány > Kémia > Általános kémia > Kolloidika
- Természettudomány > Kémia > Általános kémia > Termokémia
- Természettudomány > Kémia > Tankönyvek > Felsőoktatási
- Tankönyvek, jegyzetek, szöveggyűjtemények > Természettudományok > Kémia > Felsőoktatási